MARCIO HENRIQUE LACERDA ARNDT, MSc., PhD.
CEO & FOUNDER ENZYTEC BIOTECNOLOGIA
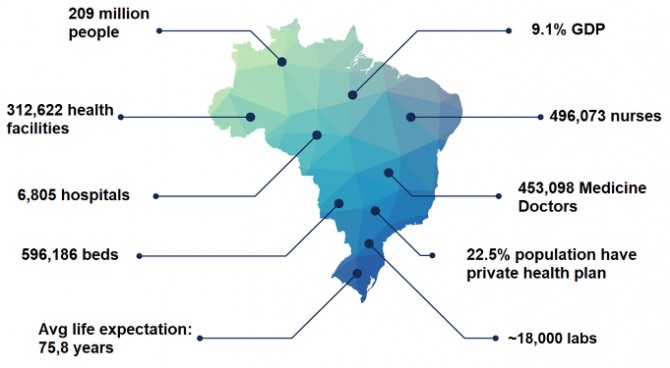
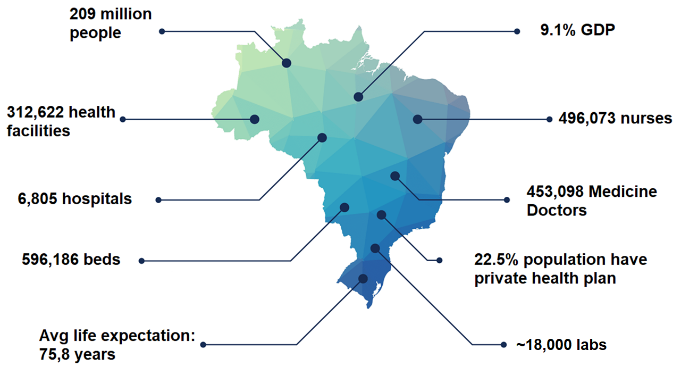
브라질 보건 시장은 세계 8위 규모로 이중 체외진단(IVD - In Vitro Diagnostics) 시장은 약 17억 달러로 지난 10년간 평균 8%의 성장률을 기록했다. 약 2억900만 명의 인구를 보유하고 있는 브라질에는 약 6800개의 병원과 1만 8000개의 질병검사센터가 있다.
브라질 보건시장(2019년 11월 기준)
자료: www.hospitalar.com
브라질 사람들의 삶의 질이 향상되고 각종 식품 및 건강 시스템에 쉽게 접근할 수 있게 되면서 평균 수명은 점점 높아지고 있다. 현재 브라질 사람들의 평균 수명은 75.8세로 인구가 고령화되고 있음을 의미한다. 2030년에는 브라질 인구의 절반 이상이 40세 이상이 될 것으로 전망되는데, 이는 종양, 당뇨병, 퇴행성 신경 질환 등 중 장년 및 노년 인구가 흔히 걸릴 수 있는 각종 질병에 대한 철저한 대비책이 필요함을 의미한다. 이 같이 인구 고령화가 지속되고 있는 브라질은 외국 기업, 특히 의료 기기 및 체외 진단(IVD) 장비 업체에 있어 투자를 고려해 볼 만한 매우 매력적인 시장이다.
위생감시국(ANVISA)
위생감시국(ANVISA-Agência Nacional de Vigilância Sanitária)은 국가의 보건 위생 시스템을 총괄하는 기관으로 보건부 소속이다.
ANVISA의 업무는 5가지 주요 분야로 구분되며, 이와 관련된 근거 법령은 아래와 같다.
1. 식품 및 식품 보조제(RDC 275/2002)
2. 화장품 및 미용 제품 (샴푸, 컨디셔너, 바디 로션, 향수 등)(RDC 07/2015 및 RDC 48/2013.)
3. 의약품- 의약품 제조 품질 관리 기준(GMP)(RDC 17/2010)
4. 살균제(세제, 소독제 등)(RDC 47/2013)
5. 의료 장비(일반 의료 및 치과 및 진단용 장비, 병원용 제품 및 장비 등)(RDC 16/2013)
ANVISA는 브라질의 위생 감시를 담당하는 연방 정부 소속 기관으로 주 정부 및 시 정부가 제정한 규제 조치를 관리하고 기술지원 서비스를 제공한다. 각 정부는 해당 영역 내의 규제 안에서 활동해야 하며 다른 영역의 정부로부터 규제 받지 않는다.
ANVISA는 위생 감시가 필요한 제품의 등록을 의무화함으로써 제품을 관리한다. 또한 AFE(ANVISA가 발급한 영업 허가)를 취득한 제조 업체, 유통 업체, 수입 업체 및 운송 업체를 관리한다. 즉 AFE를 보유한 회사만이 위생관리대상 제품을 생산, 유통, 수입, 운송할 수 있다. 또한 ANVISA 등록을 정식 취득한 제품만이 브라질 국내에서 제조 및 판매될 수 있다.
주 및 시 정부 차원에서 운영하는 위생감시국은 ‘VISA’라는 약어로 표시되며, 위생 및 건강 관련 문제를 관리·감독한다. ‘VISA’들은 위생 감시가 필요한 품목의 GMP를 포함한 제조과정, 보관 및 운송 등을 관리한다.
브라질 시장 진출 방안
브라질 위생 규제에 대한 개요를 이해한 후에는 다음과 같은 전략을 통해 시장에 진출할 수 있다.
1) 수입 업체·유통 업체와의 파트너십
2) 수입업체·유통업체·제조 업체와의 파트너십
3) 위의 두 가지 유형의 회사 중 하나를 인수
4) 수입·유통 업체 또는 수입·유통·제조 업체를 자체적으로 설립
5) ANVISA 등록 취득이 가능한 Holder업체(수입·유통업체 또는 수입·유통·제조업체)를 이용
· Holder. 업체는 영업허가(AFE), 수입 면허, 생산 인프라 보유
ANVISA로부터 허가를 취득한 업체만 제품을 등록, 수입, 유통 및 제조 할 수 있음을 강조하는 것이 중요하다. 수입, 유통 및 제조 업무를 하지 않는 일반 사무소는 ANVISA 등록의 소유주가 될 수 없다.
일반적으로 외국 업체가 1번 진출 방안 또는 2번 진출 방안을 선택하는 경우 브라질 현지 파트너와의 계약 체결은 비교적 쉽다. 그러나 제품 판매가 예상대로 되지 않거나 브라질 현지 파트너가 제품을 더 이상 취급하려 하지 않기로 결정한 경우에 ANVISA 등록은 현지 파트너 업체에 속하기 때문에 외국 회사는 새로운 파트너를 물색해 등록을 다시 취득해야 하는 불편을 겪을 수도 있다.
3번 진출 방안은 인수하려는 회사가 이미 ANVISA 등록(시설 및 제품)을 보유하고 있는 경우에 가능하다. 그러나 기업 인수를 위한 재정적 투자 외에도 인수 대상 업체의 이력 및 브랜드 가치 등을 신중하게 평가해야 한다.
4번 진출 방안은 외국 회사에 브라질에서 사업을 독자적으로 운영할 수 있는 자율권을 부여한다는 장점이 있다. 그러나 판매 성과를 올리는데 시간이 오래 걸릴 수 있고 상당한 투자도 필요하다는 점을 고려해야 한다.
5번 진출 방안은 브라질에서 사업을 시작하기 위한 최선의 전략 중 하나로 간주되고 있다. 외국 회사는 Holder 업체가 보유한 영업 허가 및 인프라를 이용할 수 있다는 장점이 있다. 이 경우 제품 등록 소유권은 브라질 업체가 가지게 된다. 그러나 Holder 업체들은 회사 정책 상 외국 기업과 경쟁하지 않으며, 갑자기 제품 취급을 중단하거나 하는 행동을 취하지 않는다. 이 같은 Holder 업체를 통해 진출한 외국 기업들은 다수의 유통 업체를 동시에 보유할 수 있으며, 판매 실적이 부진한 업체와는 즉각적으로 거래를 중단할 수 있다는 장점이 있다. Holder 업체를 통한 진출 비용은 일반적으로 높지 않은 편이며, 시장에 대한 접근도 훨씬 빠르다.
Holder 업체는 반드시 무역 경험이 많은 업체 중에서 선택하는 편이 좋다. 왜냐하면 무역을 처음 시작하는 업체는 수입량 한도가 낮고 한도를 올리기 위해서는 일정 기간이 지나야 하는 반면, 무역 경험이 많은 업체의 경우는 수입량이 제한되지 않기 때문이다.
체외진단 제품의 등급 분류
체외진단(IVD - In Vitro Diagnostics) 제품은 4등급으로 분류된다. 등급1과 등급2 제품은 ANVISA에 의해 인체에 대한 위험도가 비교적 낮은 제품으로 분류되며 브라질 수입업자, 유통업체 또는 제조 회사는 OEM 또는 고유 브랜드로 직접 제품을 등록 할 수 있다.
등급3과 등급4는 ANVISA에 의해 인체에 대한 위험도가 중간 수준과 높은 제품으로 각각 분류된다. 특히 등급4의 제품과 등급3의 일부 제품(뎅기열, 지카 바이러스, 치쿤군야 관련 제품)의 경우에 브라질 공공제약연구소 FIOCRUZ 소속 국가건강품질관리 연구소(INCQS-Instituto Nacional de Controle de Qualidade em Saúde)의 평가 및 승인을 받아야 등록 절차가 완료된다.
등급 3과 등급 4에 해당하는 제품은 아래와 같은 3가지 조건을 갖췄을 경우 등록이 가능하다.
1) 외국 회사가 이미 ANVISA를 통해 GMP를 받은 경우(GMP에는 1~2년이 소요되며, 브라질 파트너에게 약 2만 달러 상당의 GMP비용을 지불해야 함. 파트너가 추가되는 경우에 비용도 추가됨.)
2) 외국 회사가 이미 MDSAP를 통해 GMP를 받은 경우(브라질 파트너에게 약 2만 달러 상당의 GMP비용을 지불해야 함. 파트너가 추가되는 경우에 비용도 추가됨.)
3) 외국 회사가 중요한 생산 과정의 일부를 브라질 파트너에게 이전하는 경우(GMP가 면제되며, 국산 제품으로 등록됨. 그러나 반드시 브라질 국내에서 파일럿 로트를 생산하고 품질 테스트를 거쳐야 등록이 가능함.)
아래는 브라질 시장 진출 방법에 따른 예상 소요 기간이다. 소요 기간은 대략적인 추정치이며, 해당 정부 기관의 행정 처리 속도에 따라 달라질 수 있다.
브라질 체외진단(IVD) 시장 진출 방법에 따른 예상 소요 기간
자자료: ENZYTEC BIOTECNOLOGIA 자체 분석
※ 해당 원고는 외부 전문가가 작성한 정보로 KOTRA 공식의견이 아님을 알려드립니다.