- 인도, 코로나19 재확산으로 백신 및 치료제 수요 급증 -
- 2020년 코로나19 치료제에 이어 2021년 코로나 백신 긴급사용 승인 잇달아 -
인도 내 의약품 및 의료기기 수요 급증과 대응 현황
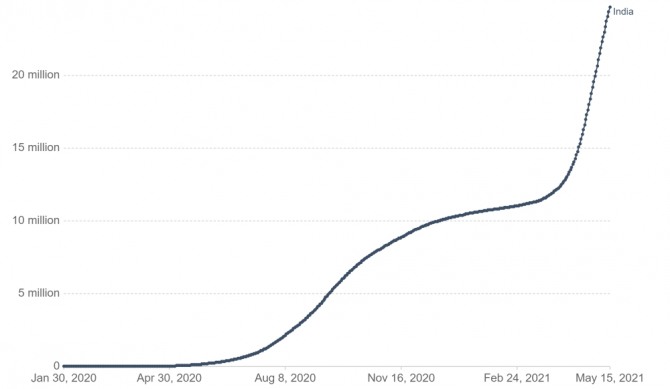
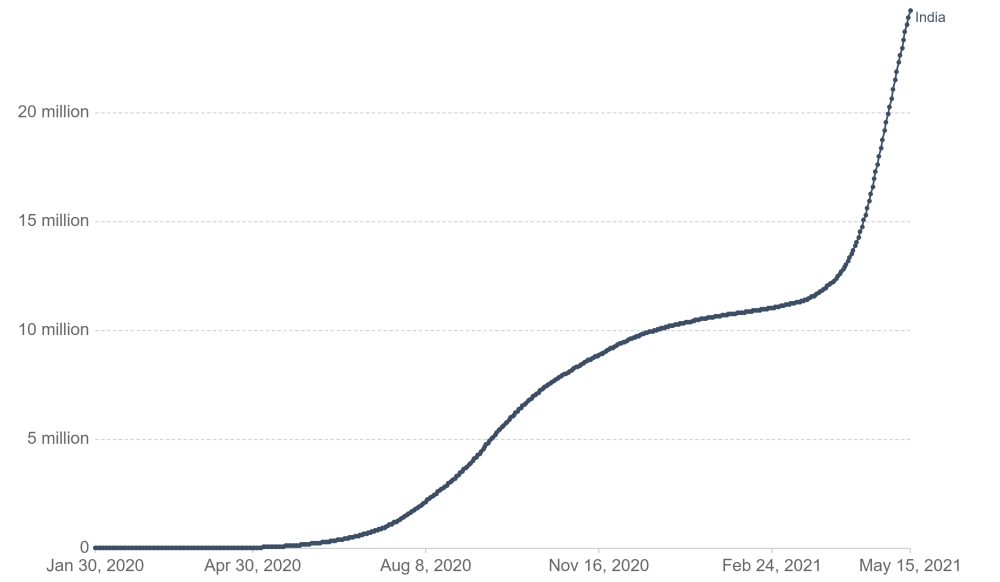
인도의 일일 코로나19 확진자 수는 2020년 9월 기존 최고치인 약 10만 명을 기록한 이후 올해 2월까지 꾸준히 감소했으나, 2021년 4월 중순 이후 크게 증가하면서 5월 20일 기준 누적확진자는 약 2603만 명을 기록했다. 그러나 5월 21일 기준 일일 확진자가 26만 명 이하로 감소하고, 코로나19 백신 접종 횟수도 약 1억9000만 회에 달하는 등 조금씩 진정세에 접어들고 있다.
인도 코로나19 누적 확진자 현황
자료: 존스 홉킨스 대학교 CSSE
이에 따라 인도 정부는 코로나19 발생 이후부터 지금까지 코로나19 확산에 대응하기 위해 백신, 치료제 등 코로나 관련 물품의 인도 내 공급을 원활하게 하기 위한 여러 조치를 취하고 있다.
인도 정부의 코로나19 관련 물품 대응 현황
| 코로나 백신 | - 2021년 4월 12일 세계보건기구(WHO)가 긴급사용 목록(EUL)에 포함 여부를 검토 중인 스푸트니크 V 백신에 대해 긴급 승인(인도 내 생산되는 아스트라제네카의 코비실드 백신과 현지 업체 바라트 바이오테크가 자체 개발한 코백신에 추가해 해외 생산 백신의 첫 승인 사례) - 2021년 4월 24일부터 7월 31일까지 코로나 백신 수입 시 관세 및 건강세(Health Cess) 면제 적용 - 수입하는 물품이 판매용이 아닌 기부물품인 경우 관세, 건강세, 통합부가세(IGST) 등 수입 시 부과되는 세금 면제 적용 * EUL: 세계보건기구(WHO)는 안전, 효과 및 품질 등을 검토해 백신의 긴급사용 목록(EUL)을 만들어 전 세계 각국이 백신을 수입하고 관리하기 위한 승인을 신속하게 진행하는데 참고할 수 있도록 정보를 제공하고 있음 |
| 코로나 치료제 | - 2020년 6월 21일 코로나19 중증 환자 치료제인 렘데시비르(Remdesivir)에 대해 일부 임상시험 절차를 생략하고 긴급 승인 - 2021년 4월 11일부터 렘데시비르 주사약과 원료 수출 잠정 중지(현재 인도 내 7개의 제약업체가 개발사인 길리어드 사이언스와 계약을 통해 렘데시비르 복제약을 생산하고 있음) - 2021년 4월 20일부터 10월 31일까지 렘데시비르 제조원료 및 주사약 수입 시 관세 면제 적용 |
| 산소 관련 물품 | - 2021년 4월 24일부터 7월 31일까지 산소 및 산소 관련 의료기기 수입 시 관세 및 건강세 면제 적용 - 수입하는 물품이 판매용이 아닌 기부물품인 경우 관세, 건강세, 통합부가세(IGST) 면제 적용 - 산소발생기 등 코로나 관련 물품에 대해 우선 통관을 시행하고, 통관 관련 문의사항이나 애로 발생 시 신속한 해결을 요청할 수 있는 헬프데스크 및 온라인 신청 절차 개설 |
| 진단키트 | - 2020년 3월 19일부터 진단키트에 대해 중앙의약품표준관리기구(CDSCO)의 인증기간을 단축하는 패스트 트랙 시행 중 - 미국의 FDA 및 EU의 CE 인증제품은 별도의 샘플 테스트를 시행하지 않고 CDSCO 인증 신청 가능 - 미국의 FDA 또는 EU의 CE 인증이 없는 제품은 인도 지정 시험실에서 샘플 검사 후 합격하면 해당 검사결과를 토대로 CDSCO 인증을 신청가능 및 총 인증 취득 기간을 1~8주 이내로 단축해 운영 |
인도의 의약품 승인 절차
인도 내 의약품 사용 승인을 받기 위해서는 2019년 제정된 신약법(the New Drugs and Clinical Trials Rules)에 따라 지정 윤리위원회(IEC) 및 중앙의약품표준관리기구(CDSCO)로부터 임상시험 수행에 대한 승인을 받고, 정해진 절차에 따라 임상시험을 수행해야 한다. 다만, 의약품의 긴급사용 승인의 경우에는 일부 임상시험 단계가 생략될 수 있다.
인도 의약품 및 코로나 백신 승인 절차 개요
| 의약품 일반 승인 절차 (인도 신약법 근거) | 코로나19 관련 의약품 긴급사용 절차 (CDSCO, 2021.4.15. 고시 근거) |
| - 의약품을 임상시험 제안서를 윤리위원회에 제출해 승인을 받아야함. - Form CT04(임상시험 승인 신청서)를 작성해 의약품의 성분 정보, 동물 임상실험정보, 독성학적 정보, 임상시험정보 등과 함께 SUGAM(www.cdscoonline.gov.in)에 제출해 임상시험 승인 신청을 하고, CDSCO는 90일 이내 승인 여부를 결정해야 함. - 임상시험 진행 중 내용이 변경될 경우 CDSCO와 윤리위원회에 서면으로 해당 내용을 통지해야 함. - 임상시험 완료 후 CDSCO와 윤리위원회에 최종 결과보고서를 제출해 사용 승인을 받아야 함. - 외국 제조자의 경우 등록신청서(Form 40)를 CDSCO에 제출해 등록증(Form 41)을 받아야 하고, 의약품 수입자의 경우 수입허가 신청서(Form 8)를 CDSCO에 제출해 수입허가증(Form 10)을 받아야 함. - 의약품 시판 후 추가적인 평가가 필요한 경우 정기적인 안전성 정보 보고서(PSUR) 제출 필요함. * SUGAM : CDSCO의 온라인 접수처 | - 의약품 긴급사용 적용 신청서와 의약품의 성분 정보, 임상시험 정보, 분석 결과서, GMP(Good Manufacturing Practices) 인증, 다른 나라에서 법적으로 사용 승인을 받은 근거 자료 등을 SUGAM(www.cdscoonline.gov.in)을 통해 제출해 CDSCO에 승인 신청을 하고, CDSCO는 인도 신약법의 신속 승인 절차를 근거로 3일 이내 승인 여부를 결정해야 함. - 미국 식품의약국(FDA), 유럽 의약품청 (EMA), 영국 의약품청(MHRA)에 의해 제한적 긴급사용승인(Emergency Approval for Restricted Use)을 받거나 WHO의 긴급사용목록(EUL)에 포함된 코로나 백신에 대해 긴급사용을 승인할 수 있음. - 백신 프로그램에 의한 공급 전에 100명에 대해 접종 후, 7일간 안전성 평가가 수행돼야 하고, CDSCO는 평가 결과를 재검토해야 함. - 긴급사용 승인 이후 30일 이내에 CDSCO에 가교임상시험 수행을 위한 승인 신청을 해야 하고, CDSCO는 3일 이내 CDSCO에 설치된 전문가 패널(SEC) 회의에서 승인여부를 결정해야 함. - CDSCO는 해당 가교임상시험 수행 결과를 검토해 최종 승인 여부 결정 |
코로나19 관련 물품 신속 통관 및 인증 면제
인도 간접세위원회(CBIC)는 인도 내 산소발생기 등의 수요가 급증함에 따라 2021년 4월 24일 코로나19 관련 물품의 우선 통관 적용 시행을 발표했다. 대상 물품은 의약품 원재료, 생명 연장 의약품, 산소 관련 의료기기 등 코로나19의 상황을 극복할 수 있도록 돕는 물품이라고 정의하고 있다. 이와 관련해 수입자는 코로나19 관련 물품의 통관 지연 발생 시 온라인 서식에 수입자, 신고일, 수입시고번호, 물품 명세 등을 작성 및 제출해 통관 관련 애로 해소를 신청할 수 있다.
신청서식 바로가기
또한, 간접세위원회(CBIC)는 각 지역 세관별 공무원을 지정해 신속 통관 관련 사항을 문의할 수 있는 헬프데스크를 개설했다. 지정된 공무원의 휴대전화 및 이메일로 문의해 코로나 관련 물품의 통관 지연 등의 문제 발생 시 신속하게 대응할 수 있다.
코로나19 물품 통관 관련 지정 공무원 및 연락처
| 연번 | 세관 | 성명 | 연락처 | 이메일 | 직책 |
| 1 | Ahmedabad | Shankesh Mehta | 9586992221 | shankhesh.m@gov.in | Joint Commissioner |
| 2 | Bengaluru | Nasser khan S | 9846062152 | nasser.khan@nic.in | Additional Commissioner |
| 3 | Chennai | John IIango | 9952092480 | liojohnilango@gmail.com leo.john1966@gov.in | Joint Commissioner |
| 4 | Delhi | Arjun Lal Jat | 8130144488 | arjun.irs2009@gov.in | Joint Commissioner |
| 5 | Delhi, Prev Ludhiana | Parul Garg | 7340960775 | parul.garg@gov.in | Additional Commissioner |
| 6 | Kolkata | Basant Kumar | 8902408360 | basant.k68@gov.in | Joint Commissioner |
| 7 | NCH, Mumbai I | Ayaz Ahmed Kohli | 9810286644 | ayaz.kohli@gov.in | Additional Commissioner |
| 8 | JNCH, Mumbai II | Dipin Singla | 9711105944 | adccccu-jnch@gov.in | Additional Commissioner |
| 9 | Mumbai III, Air Cargo | Vishal Sanap | 9619000050 | vishal.sanap@gov.in | Additional Commissioner |
| 10 | Patna | Pratul Tiwari | 9702831544 | pratul1.tiwary@icegate.go v.in | Joint Commissioner |
| 11 | Trichy | JMD Navfal | 9500015250 | jm.navfal@nic.in | Additional Commissioner |
| 12 | Bhopal | Manish Jaiswal | 9111111651 | manish.jaiswal@gov.in customsindore@gov.in | Additional Commissioner |
| 13 | Nagpur | Mukul Patil | 7600059543 | mukul.patil@gov.in | Joint Commissioner |
| 14 | Pune | Dhruva Sheshadri | 9442269473 | dhruva.seshadri@gov.in | Joint Commissioner |
| 15 | Meerut | Umesh Kumar | 9051411166 | umesh.noba@gov.in | Joint Commissioner |
| 16 | Hyderabad | Uma Shanker Goud | 9052299001 | umashankar.sa@gov.in goudumashanker@rediffmail.com | Additional Commissioner |
| 17 | Visakhapatnam | Y Bhaskara Rao | 8297974912 | y.bhaskararao@gov.in | Joint Commissioner |
| 18 | Odisha | J. Sateesh Chander | 8879149363 | sateesh.chandar@nic.in | Additional Commissioner |
| 19 | Guwahati | JK Simte | 9810104280 | Jk.simte@gov.in Jksimte@gmail.com | Joint Commissioner |
| 20 | Kochi | J Harish | 9886187088 | dr.harish@nic.in | Joint Commissioner |
호흡기 치료기기, 백신, 진단키트 등을 인도에 수출하기 위해서는 사전에 중앙의약품표준관리기구(CDSCO)의 인증 취득이 필요하나 인도 정부 또는 인도 적십자가 수입하는 기부 물품인 경우에는 수입 인증 등의 요건 서류 없이 통관이 가능하다. 일반 수입의 경우 산소는 위험물로 분류되므로 인도 수입 통관 시, CDSCO에서 통관 가능하다고 확인을 한 서류인 NOC(No Objection Certificate)가 필요하며, 진단키트, 백신, 호흡기 치료용 의료기기는 수출 전 인증 취득이 요구된다. 다만, 진단키트의 경우 2020년 3월 19일부터 인증 취득기간을 단축 및 미국의 FDA 또는 EU의 CE 인증 제품은 샘플 테스트 절차를 생략 가능하다. 백신과 치료제의 경우에는 신약법에 따른 신속 승인 절차를 적용해 승인을 받을 경우 별도의 수입 인증 취득이 면제된다. 또한, 비캐뉼라 장치(Nasal canula device), 중환자용 인공호흡기(ICU ventilator), 네블라이저(Nebulizer)와 같은 호흡기 치료용 의료기기 외 일반 산소발생기, 산소실린더는 CDSCO 인증 없이 수출이 가능하다.
시사점
인도 보건·가족복지부(MoHFW)는 2019년 신약법(the New Drugs and Clinical Trials Rules)을 제정해 의약품의 임상시험 및 승인 관련해 적용하고 있다. 이전에는 의약품 승인 여부 결정에 6개월 이상 소요됐지만, 새로운 법에 따르면 의약품 승인기관인 중앙의약품표준관리기구(CDSCO)가 임상시험에 대한 결정을 내릴 기한을 명시, 2개국 이상에서 수행하는 글로벌 임상시험의 승인 여부는 90일 내에 인도 내 임상시험 승인 여부는 30일 이내에 결정하도록 했다.
인도의 신약법(the New Drugs and Clinical Trials Rules 2019)에 근거하면 심각한 희귀 질병, 생명을 위협하는 전염병 유행과 같은 상황에서 신약의 신속 승인절차(Accelerated Approval Process)를 적용 가능한 것으로 규정되어 있다. 코로나 치료제 또는 백신과 같이 급증하는 국내 수요에 맞추기 위해서 긴급하게 사용 승인이 필요한 경우 이러한 절차가 적용되고 있다.
신속 승인 절차를 적용하게 되면 인도 내에서 효능과 안전성을 평가하는 3상 임상시험을 생략하고, 장기 효과 평가를 위한 4상 임상시험만 수행하고, 별도의 수입 허가를 취득할 필요 없이 사용 가능하다. 해당 절차 적용 시 인도 CDSCO에 설치된 전문가 패널(SEC)이 이미 수행된 임상시험 결과와 과학자들이 제공한 근거 자료를 바탕으로 안전성 및 효과 등을 종합적으로 검토 후 CDSCO에 승인 여부를 권고한다. 해당 권고에 대해 CDSCO가 최종 승인 또는 거부할 권한을 가지게 된다.
CDSCO 관계자는 현지 언론을 통해 코로나 관련 의약품에 대한 전문가 패널(SEC)의 검토는 해당 의약품이 현재 코로나19 대유행 상황에서 돌파구를 제공할 가능성이 있는지를 중심으로 평가하고, FDA가 명시한 긴급 승인 원칙을 적용해 “알고 있는 잠재적 효과가 현재 유행하는 전염병의 위험보다 더 클 경우” 승인을 결정할 수 있을 것이라고 밝혔다. 현재 코로나 의약품 승인과 관련한 전문가 패널(SEC) 회의는 한 달에 3회 내지 4회 진행되고 있다.
2021년 4월 15일 CDSCO가 발표한 코로나 백신의 긴급 사용을 위한 절차를 살펴보면, 이미 다른 국가 또는 기관에 의해 긴급사용 승인을 받은 경우에는 인도 CDSCO에 의해서도 승인이 가능한 것으로 보인다. 단, 100명을 대상으로 안전성을 우선 평가하고, 가교임상시험을 수행하는 등 여러 단계를 거쳐 검토한 후에 최종 승인이 가능하다.
의약품의 일반적인 사용 승인 절차는 신약법을 근거로 관련 규정을 파악할 수 있지만, 긴급 사용에 대한 절차는 구체적으로 규정돼 있지 않기 때문에 인도 내 의약품 긴급사용 승인을 받고자 하는 경우에는 현재 인도 내 코로나19의 2차 대유행이라는 특수한 상황과 코로나 관련 의약품 공급 원활화를 우선시 하는 동시에 안전성 검증을 병행하고 있는 CDSCO 가이드 내용을 고려할 필요가 있다. 또한, 이미 인도에서 긴급 승인을 받은 바 있는 의약품의 실제 사례를 참고해 물품 및 사안별 차별화된 대응이 필요하다.
자료: CBIC, 인도 신약법, CDSCO, KOTRA 뉴델리 무역관 자료 종합