 이미지 확대보기
이미지 확대보기그러나 환자 한 명당 연간 5만6000달러의 막대한 비용이 들어가는 높은 가격을 두고 거센 논란이 일고 있다.
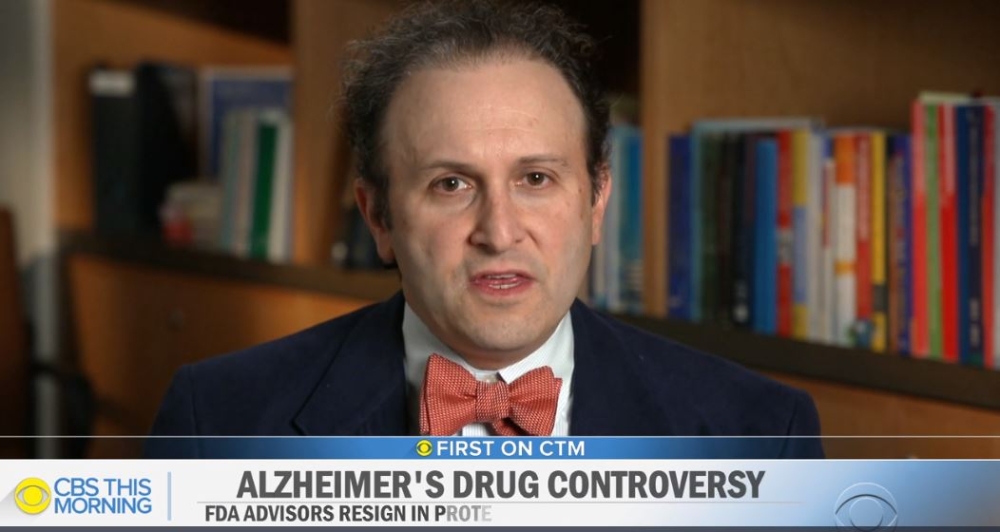
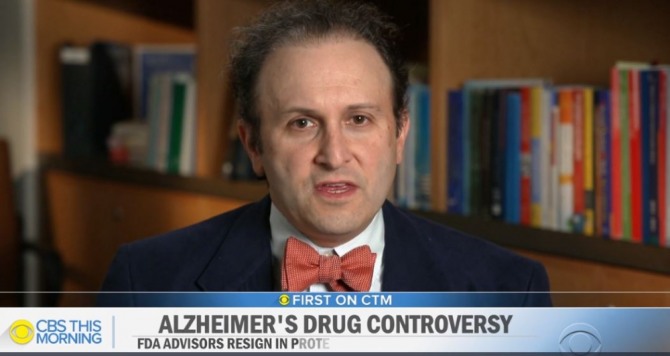
21일(현지시간) 미국 CBS는 논란이 되고 있는 상품명 '애듀헬름(Aduhelm)'의 승인 이후 FDA 자문직을 사임한 하버드 의과대학 교수 애런 케셀하임(Aaron Kesselheim)과의 인터뷰를 방영했다.
애런 케셀하임 교수는 이 치료법이 "효과가 있다는 좋은 증거를 보여주지 못했다"며 "최근 미국 역사상 최악의 약물 승인 결정"이라고 평가했다.
케셀하임 교수는 CBS에게 "중요한 부작용이 있었다"며 "FDA는 지난 6개월 동안 장비를 완전히 교체했고, 애듀헬름이 '베타 아밀로이드(amyloid)'를 제거하는 효과를 인정해 승인을 내렸다"고 설명했다.
알츠하이머는 뇌에 단백질 아밀로이드가 모여 덩어리(플라크) 형태로 쌓이면 발병하는 것으로 알려져 있다.
그러나 아밀로이드 플라크를 제거한다고 알츠하이머가 치료되는지는 과학적으로 입증하지 못하고 있다.
이에 식약처 독립자문위원회는 실제 증상을 지연시키거나 예방하는지는 명확하지 않다며 해당 기관에 거부권을 행사했다.
그러나 FDA가 이 같은 경고를 무시하자 케셀하임과 다른 두 위원회 위원들은 사임했다.
FDA에 따르면 부작용으로는 두통, ARIA-Edema, ARIA-H 미세출혈, ARIA-H 중추신경계 표재성 철색소침착증 등이 있을 수 있다.
케셀하임은 "FDA가 조기에 중지된 시험, 재분석된 시험 등을 근거로 약품을 승인받을 수 있도록 허용한다면 이는 나쁜 선례가 된다"며 "다른 기업에게도 엄격한 임상 시험을 치를 필요는 없다고 생각하게 된다"고 비판했다.
그는 환자와 의사 모두 '합리적인 기준(reasonable standards)'을 기대하며 FDA에 의존한다고 강조했다.
케셀하임은 "대부분의 경우, 저는 FDA가 올바른 결정을 내린다고 생각한다”며 "이런 경우 FDA가 잘못된 결정을 내리는 경우, 왜 이런 식으로 결정이 내려졌는지 더 잘 이해할 필요가 있다고 생각한다"고 말했다.
바이오젠은 CBS에 FDA에 8건의 임상 실험 결과로 220만 페이지의 데이터와 분석을 제공했다고 전했다.
FDA 관계자는 "애듀헬름의 데이터는 매우 복잡했고, 우리는 철저하게 검토했다"고 밝혔다.
유명현 글로벌이코노믹 기자 mhyoo@g-enews.com