렘데시비르 관련주 (remdesivir) 효과 다우지수 2만4000선회복
 이미지 확대보기
이미지 확대보기미국 제약사 길리어드 사이언스의 항바이러스제 '렘데시비르' 효과이다.
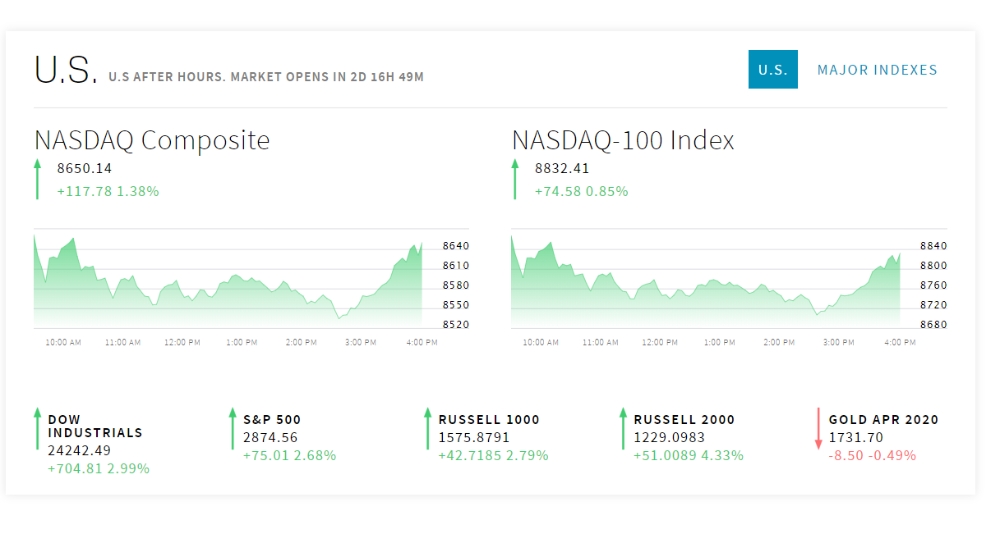
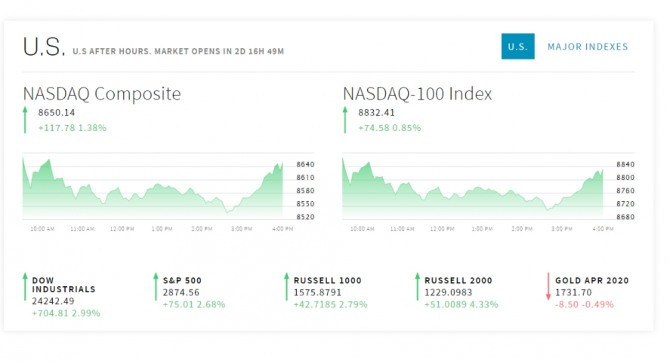
18일 뉴욕증시에 따르면 다우지수는 704.81포인트(2.99%) 오른 24,242.49에 마쳤다. 다우지수가 24,000선을 회복한 것은 3월10일 이후 약 6주만이다. 스탠더드앤드푸어스(S&P)500지수는 75.01포인트(2.68%) 상승한 2,874.56에 끝났다. 나스닥지수는 117.78포인트(1.38%) 오른 8,650.14에 감했다.
코로나19 치료제 개발에 대한 기대감이 주가지수를 끌어올렸다는 분석이 나온다. 이른바 렘데시비르 관련주 효과이다.
미국 언론들은 시카고대 연구진이 환자들에게 렘데시비르를 투약한 결과 대다수가 발열 및 호흡기 증상이 빠르게 회복돼 1주일 이내에 퇴원할 수 있었다고 대서특필하고 있다. 렘데시비르는 당초 에볼라 치료제로 개발됐다. 그럼에도 사스(SARS·중증급성호흡기증후군)와 메르스(MERS, 중동호흡기증후군) 등 코로나바이러스 계열 감염병에도 효과가 있는 것으로 평가받고 있다.
렘데시비르 관련주 덕에 유럽증시도 상승했다. 영국 런던 증시에서 FTSE 100 지수는 2.82% 상승한 5,786.96에, 독일 프랑크푸르트 증시에서 DAX30 지수는 3.15% 오른 10,625.78로 마감했다. 프랑스 파리 증시에서 CAC40 지수는 3.06% 상승한 4,483.38을 기록했다. 범유럽지수인 유로 Stoxx 50지수도 2,888.30으로 2.70% 상승했다.
미국 뉴욕증시 마감시세
U.S AFTER HOURS. MARKET OPENS IN 2D 16H 49M
NASDAQ Composite 8650.14 +117.78 1.38%
NASDAQ-100 Index 8832.41 +74.58 0.85%
S&P 500 2874.56 +75.01 2.68%
RUSSELL 1000 1575.8791 +42.7185 2.79%
RUSSELL 2000 1229.0983 +51.0089 4.33%
GOLD APR 2020 1731.70 -8.50 -0.49%
.
18일 뉴욕증시에 따르면 미국 메디컬매체인 스탯 뉴스는 16일(현지 시각) 에 따르면 시카고대학교에서 진행 중인 3단계 임상실험 결과, 코로나19로 입원한 환자들 대부분이 렘데시비르 치료 이후 열과 호흡기 증상이 해소되면서 1주일만에 퇴원했다고 보도했다. 코로나 바이러스 치료제로 주목받는 ‘렘데시비르’가 효과가 있다는 임상 시험 결과가 보도되면서 이 약을 만든 미국 바이오기업 길리어드 사이언스의 주가가 크게 뛰었다. 그러나 아직 효과를 장담하기엔 이르다는 지적도 있다. 렘데시비르는 에볼라 치료제로 개발하다 코로나19 치료 효과 가능성을 보여 대규모 임상시험이 시작된 약물이다. .
이 소식이 알려지면서 한국코스닥 에서도 렘데시비르 관련주로 뷴류되는 파미셀 한올바이오파마, 엑세스바이오,에이프로젠제약,신풍제약, 진원생명과학 등의 주가가 크게 변동했다.
다음은 렘데시비르 치료제에 관한 길리어드 사이언스의 공식 입장 .
Gilead Sciences,
An Open Letter from our Chairman & CEO
Daniel O’Day - April 10, 2020
Earlier today, the New England Journal of Medicine (NEJM) published an analysis of the effects of our investigational medicine remdesivir on a small group of patients with severe symptoms of COVID-19.
These are patients who received treatment through the compassionate use program for remdesivir, which is for critically ill patients who are unable to take part in a clinical trial. The results, which cover 53 of the first patients to have been treated in the program, show that the majority demonstrated clinical improvement after taking remdesivir. We recognize the limitations of these compassionate use data from a purely investigational perspective, while knowing they are of the greatest significance for the patients whose symptoms improved. These early data from 53 patients have not been generated in a clinical trial and cover only a small portion of the critically ill patients who have been treated with remdesivir.
Remdesivir is an investigational treatment and has not been approved for use anywhere in the world. In the broader efforts to determine whether it is a safe and effective treatment, we have some way to go. Multiple clinical trials are underway across the world to build a complete picture of how remdesivir works in various contexts. These studies cover a range of patient populations across different demographics and with varying types of symptoms: moderate, severe where patients need oxygen support, and critical where medical ventilation is required. These patients all receive remdesivir through intravenous infusions in a hospital setting.
In studying remdesivir, the question is not just whether it is safe and effective against COVID-19 but in which patients it shows activity, how long should they receive treatment and at what stage of their disease would treatment be most beneficial. Many answers are needed, which is why we need multiple types of studies involving many types of patients.
Some of these answers will start to emerge in the coming weeks as we receive the first data from the various clinical trials underway.
Clinical trials for remdesivir
Seven clinical trials have been initiated to determine whether remdesivir is a safe and effective treatment for COVID-19. Each of these was set up with unprecedented speed thanks to the remarkable efforts of the various groups involved, as well as the level of knowledge we had on remdesivir.
To some extent, the trials have had to be adaptive in design as our understanding of the disease itself continues to evolve. The virus emerged and spread at an intense speed and everyone is working quickly to understand it. Our interpretation of the results will also be shaped by what we continue to learn about the disease.
The order in which the trials were initiated mirrors the path of the pandemic. China initiated the first two studies in early February for patients with severe and moderate symptoms of the disease. Since then, an additional five trials have been initiated around the world.
Two Phase 3 studies are being run by Gilead in areas with a high prevalence of COVID-19 in the United States, Asia and Europe. One of these is for patients with severe disease and the other studies remdesivir in patients with more moderate symptoms. One of the many questions that these studies aim to answer is whether treatment duration can be shortened from 10 days to 5 days. The severe arm fully enrolled the number of patients it was originally designed for and we have now expanded the study so that thousands more patients can participate, including those on mechanical ventilation.
The U.S National Institute of Allergy and Infectious Disease (NIAID) began a global trial on February 21. This trial randomly assigns patients to treatment with either remdesivir or with a placebo to enable a controlled comparison of outcomes. The trial is enrolling approximately 800 patients with a broad spectrum of symptoms.
The World Health Organization is also conducting a global trial, Solidarity, and the Inserm DisCoVeRy trial recently began in Europe. A summary of remdesivir trials with upcoming data readouts can be found here.
We know that there is tremendous interest around when the data from these trials will be available and what they will tell us about remdesivir. We feel the urgency as we wait for the science to speak. With every day that goes by, the desperate need to equip healthcare workers and their patients with a safe, effective treatment becomes more pressing. We are working with intense speed to determine whether remdesivir could be an option and we are committed to sharing information when it becomes available to us.
We expect that we will have preliminary data from the study of remdesivir in severe patients at the end of April and will work quickly to interpret and share the findings. The publication of data from the China remdesivir trials rests with the Chinese investigators, but we have been informed that the study in patients with severe symptoms was stopped due to stalled enrollment. We look forward to reviewing the published data when available. In May, we anticipate the initial data from the placebo-controlled NIAID trial as well as data from the Gilead study of patients with moderate symptoms of COVID-19.
To a large extent, the timelines are determined by epidemiology and the numerous challenges that come with studying a treatment for a newly emerged disease. As with so much in this pandemic, this is unchartered territory for many of us involved in the process.
Ongoing collaboration
While it may feel like a long wait for data given the urgency of the situation, it has been only two months since the first clinical trials began. Given that it can take a year or more to have the first clinical data for an investigational treatment, it is remarkable that we expect to have the first remdesivir trial data so soon.
This speed is the result of strong collaboration and immense dedication among the many groups involved, from regulatory authorities to hospital administrators, clinicians and study investigators. As with all the work on remdesivir, everyone is driven by the same sense of urgency and a commitment to maintaining scientific rigor throughout.
All of us at Gilead are grateful to the many groups and organizations who are collaborating to find answers on remdesivir and above all, to the physicians and patients involved in the clinical trials. When we talk about trial results, we tend to think in terms of numbers, trends and statistics. We realize that behind each of these numbers is a patient who has agreed to take part in a trial and share the data from their personal experience. It is thanks to the thousands of patients like these and the physicians who are treating them, that we will be able to determine whether remdesivir can be used safely and effectively for many more patients in the future.
Note regarding forward-looking statements.
한편 길리어드 사이언스가 코로나19 치료제 후보로 거론되는 항바이러스제 렘데시비르의 생산을 확대한다고 발표하면서 관련주에 대한 기대도 커지고 있다.
미국 제약사 길리어드 사이언스가 직접 개발한 에볼라 치료제 ‘렘데시비르’가 코로나 치료에 효과가 있다고 알려지면서 관련주에 투자자들의 관심이 높다.
임상 시험 결과가 보도되면서 길리어드 사이언스의 주가가 시간외 거래에서 15% 이상 급등한 것으로 전해지자 17일 국내 증시에서 관련주 향방에 관심이 쏠리고 있다.
증권가에선 렘데시비르 관련주로 파미셀에 관심이 쏠리고 있다.
파미셀은 렘데시비르 주원료인 `뉴클레오시드`를 생산하고 있다. 파미셀은 글로벌 진단용 및 의약용 뉴클레오시드 시장의 80% 이상을 점유하고 있다.
이어 한올바이오파마, 엑세스바이오,에이프로젠제약,신풍제약,진원생명과학등도 거론되고 있다.
그러나 렘데시비르의 코로나 치료 효과와 부작용 가능성 등이 완전히 규명되기 이전이라는 점에서 투자에 신중을 기해야 한다는 지적이 일고 있다.
국제유가는 17일(현지시간) 하락 압박을 받았다.
이날 뉴욕상업거래소에서 5월 인도분 서부 텍사스산 원유(WTI)는 전날보다 배럴당 8.1%(1.60달러) 급락한 18.27달러에 거래를 마쳤다.
이로써 WTI는 이번 주 20%가량의 낙폭을 기록했다.
5월물 WTI의 만기가 임박한 상황에서 거래가 줄면서 상대적으로 낙폭이 커진 것으로 분석된다. 6월 인도분 WTI는 25.14달러로 1.5%(0.39달러) 하락하는 데 그쳤다.
런던 ICE 선물거래소의 6월물 브렌트유는 오후 4시 현재 2.01%(0.56달러) 상승한 28.38달러에 거래되고 있다.
OPEC+(OPEC과 10개 주요 산유국의 연대체)는 5~6월 두 달 간 하루 970만 배럴의 원유를 감산하겠다는 합의를 이뤘지만, 신종 코로나바이러스 감염증(코로나19) 사태에 따른 수요 감소 우려를 불식하지는 못하고 있다.'
국제금값은 하락했다.
이날 뉴욕상품거래소에서 6월 인도분 금은 전날보다 온스당 1.9%(32.90달러) 하락한 1.698.80달러에 마감했다.
주간 기준으로는 3.1% 하락했다.
김대호 글로벌이코노믹 연구소장 tiger8280@g-enews.com