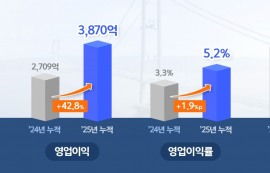
선천성 고인슐린증 치료제 에페거글루카곤…세계 최초 주 1회 제형 도전
 이미지 확대보기
이미지 확대보기FDA의 BTD는 중대한 질환 치료에서 기존 치료제 대비 임상적으로 개선 가능성을 임상 데이터를 통해 확인된 의약품을 신속한 허가를 지원하기 위해 다양한 혜택을 부여하는 제도이다. BTD로 지정받은 치료제는 FDA로부터 임상부터 허가까지 개발 전반에 대한 집중적인 자문과 지원을 받게 되며, 허가 신청 시 자료를 부분적으로 제출해 검토받을 수 있는 순차 심사가 허용된다. 더불어 우선 심사 등 심사 가속화 제도의 적용 가능성이 확대돼 개발 및 허가 절차 효율성이 높아질 것으로 기대된다.
선천성 고인슐린증은 인슐린이 과도하게 분비돼 저혈당증을 유발하는 희귀질환이다.현재까지 선천성 고인슐린증을 특정 적응증으로 한 FDA 승인 치료제는 없으며, 고인슐린증으로 인한 저혈당 조절의 목적으로 승인된 기존 치료제는 1건이다. 치료 반응이 특정 유전자형에 한정돼 부작용으로는 △다모증 △체액 저류 △심부전 등이 심해, 환자들은 허가 이외의 의약품을 사용하거나 궁극적으로 부작용을 감수하고 췌장을 절제하는 수술에 의존하고 있다.
한미약품은 기존 치료방식의 한계를 극복할 수 있는 선천성 고인슐린증 치료제 에페거글루카곤을 세계 최초 주 1회 투여 제형으로 개발 중이다.
최인영 한미약품 R&D센터장은 “FDA의 혁신치료제 지정은 해당 신약의 긴박한 상용화 필요성은 물론, 실제 개발 가능성에 대해 FDA가 높은 평가를 내렸다는 객관적인 지표”라며 “보다 빠른 개발을 통해 해당 질병으로 고통받는 환자들에게 큰 희망을 줄 수 있도록 회사의 모든 역량을 집중하겠다”고 말했다.
한편 에페거글루카곤은 선천성 고인슐린증 치료제로서 이미 미국 FDA, 유럽 의약품청(EMA), 한국 식품의약품안전처(MFDS)로부터 희귀의약품(ODD) 지정을 받았으며, 미국 FDA에서는 소아 희귀질환 치료제(RPD)로도 지정했다. 또한, EMA는 에페거글루카곤을 인슐린 자가면역증후군 치료를 위한 희귀의약품으로도 지정해, 해당 신약의 광범위한 잠재력을 높이 평가한 바 있다.
황소원 글로벌이코노믹 기자 hwangsw715@g-enews.com