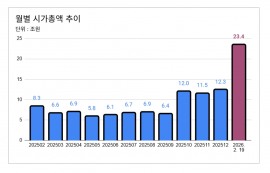
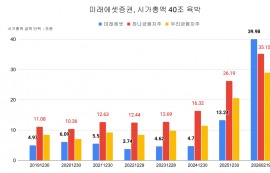
CSU 환자 150명 대상 아시아·유럽서 진행
오말리주맙 불응 환자까지 포함
오말리주맙 불응 환자까지 포함
 이미지 확대보기
이미지 확대보기유한양행은 레시게르셉트 임상2상 주요 계획을 미국 국립보건원의 임상시험 정보 공개 사이트인 클리니컬트라이얼즈에 등재했다. 이 임상은 CSU 환자 150명을 대상으로 레시게르셉트 또는 위약을 12주간 투여한 뒤 안전성과 유효성을 평가하도록 설계됐다. 1차 평가변수는 베이스라인 대비 12주 시점의 지난 7일간의 두드러기 활성 점수(UAS7) 변화로 설정됐다. 시험은 대한민국을 포함해 △일본 △중국 △불가리아 △폴란드 등 아시아와 유럽 지역에서 진행될 예정이다.
다국가 임상 2상은 이번 연구 개시를 시작으로 본격 운영에 들어갈 예정으로 오는 2027년 7월 마지막 시험대상자 종료를 예상하고 있다. 주요 결과는 4분기 도출을 목표로 하고 있다. 레시게르셉트는 지난해 10월 대한민국 식품의약품안전처로부터 임상 2상 임상시험계획(IND) 승인을 확보에 이어 중국 규제 당국으로부터도 이번 IND 승인을 확보하면서 다국가 2상 운영의 기반을 넓혔다. 유럽 내 일부 국가들은 현재 임상시험 승인(CTA) 심사 단계에 진행중으로 승인 일정에 맞춰 시험 개시 국가가 단계적으로 확대될 전망이다.
앞서 수행한 임상 1상 시험을 통해 안전성과 예비적 개념 증명을 확인한 바 있다. 특히 CSU 환자에서 알레르기를 유발하는 혈중 물질(IgE) 억제가 대조약인 오말리주맙 대비 더 강하고 오래 지속되는 경향을 보였다. 또한 유한양행은 CSU 임상 평가 지표인 UAS7 기반 평가에서도 증상 개선 신호가 확인됐다.
김열홍 유한양행 R&D 총괄 사장은 “만성 자발성 두드러기 환자 대상의 이번 임상 2상은 아시아 및 유럽 국가의 보다 많은 환자에서 레시게르셉트의 안전성, 유효성 및 임상적 특장점을 확인할 목적으로 진행될 것”이라며 “오픈 이노베이션을 통한 글로벌 R&D 확대 전략의 또 하나의 모범 사례가 될 것”이라고 말했다.
유한양행은 이번 임상 2상에서 의미 있는 데이터를 확보해 추가 적응증 확장 및 후속 글로벌 개발 전략을 본격적으로 구체화한다는 방침이다.
황소원 글로벌이코노믹 기자 hwangsw715@g-enews.com